Tác dụng của diclofenac, aceclofenac và meloxicam đối với quá trình chuyển hóa proteoglycans và hyaluronan trong sụn của người bị thoái hóa khớp
Trích lược
- Vì các thuốc kháng viêm Non-steroid (NSAID) có thể làm giảm khả năng phục hồi hư tổn hệ đệm ngoại bào của tế bào sụn, chúng tôi đã phát hiện ra những thay đổi trong quá trình chuyển hóa của các phân tử proteoglycan và hyaluronan (HA) mới tổng hợp, được sản xuất bởi aceclofenac, diclofanac trong sụn khớp của người mắc bệnh thoái hóa khớp (OA).
- Những tế bào được nuôi cấy đã được lấy mẫu từ đầu lõi xương đùi giữa và được phân loại bằng cách sử dụng hệ thống phân loại điểm mô học và mô hóa học của Mankin. 20 đối tượng có mẫu sụn biểu hiện viêm khớp trung bình, 20 đối tượng có mâũ sụn biểu hiện viêm khớp nặng.
- Các tế bào sụn được nuôi cấy được cho [‐3H]‐ glucosamine, và sau đó được kiểm soát với những thuốc aceclofenac, diclofenac hoặc meloxicam có nồng độ 0.3–3 μg ml−1 hoặc không có. Sau khi được cho tiêu hóa với papain, chondroitin sulphate ([‐3H]‐ proteoglycans) và [‐3H]‐HA đươc đưa vào mô và môi trường được làm tinh khiết hóa bằng phương pháp trao đổi ion săc ký.
- Trong sụn của thoái hóa khớp trung bình (MOA) và thoái hóa khớp nặng (SOA), sự cân bằng chuyển hóa của proteoglycan và HA không bị ảnh hưởng bởi diclofenac. Ngược lại, theo cách phụ thuộc liều, cả aceclofenac và meloxicam đều làm tăng tổng hợp proteoglycan và HA trong các mô cấy của MOA và SOA; hai NSAID này cũng làm giảm đáng kể sự mất đi các phân tử [3H ] proteoglycans và [3H] HA trong các tế bào sụn được nuôi cấy.
- Dữ liệu thu được trong nuôi cấy trong ống nghiệm ngắn hạn chỉ ra rằng ở nồng độ được tìm thấy trong dịch bao hoạt dịch, aceclofenac và meloxicam có thể có tác dụng tích cực đối với sự chuyển hóa tổng thể của proteoglycan và HA trong sụn của thoái hóa khớp trung bình (MOA) và thoái hóa khớp nặng (SOA).
Lược dịch
Tác dụng của NSAIDs trong tổng hợp proteoglycan and hyaluronan
* Proteoglycan
Trong cả 2 nhóm, Diclofenac ở cả 3 nồng độ thí nghiệm cũng như Aceclofenac ở nồng độ 0.3μg ml−1 và Meloxicam ở nồng độ 0.3 và 1μg ml−1 không thay đổi đáng kể tổng số lượng (mô và môi trường) của các phân tử proteoglycan được tổng hợp mới. Ngược lại, sự gia tăng đáng kể trong tổng hợp proteoglycan đã được quan sát thấy, khi các tế bào sụn được nuôi cấy từ hai nhóm được ủ với aceclofenac ở nồng độ 1 và 3 μg ml−1 hoặc với meloxicam ở nồng độ 3 μg ml−1 (P = 0,002) . Trong mỗi nhóm, sự gia tăng tổng hợp proteoglycan luôn mạnh hơn khi các mô cấy được ủ bằng aceclofenac so với meloxicam (P = 0,002). So sánh sâu hơn giữa các mô cấy MOA và SOA chỉ ra rằng sự gia tăng tổng hợp proteoglycan cao hơn đáng kể ở những mô cấy có tổn thương viêm khớp kém tiến triển tại nồng độ meloxicam 3 μg ml−1 (P <0,001) và nồng độ aceclofenac là 1 μg ml−1 (P <0,001) và 3 μg ml−1 (P <0,001).
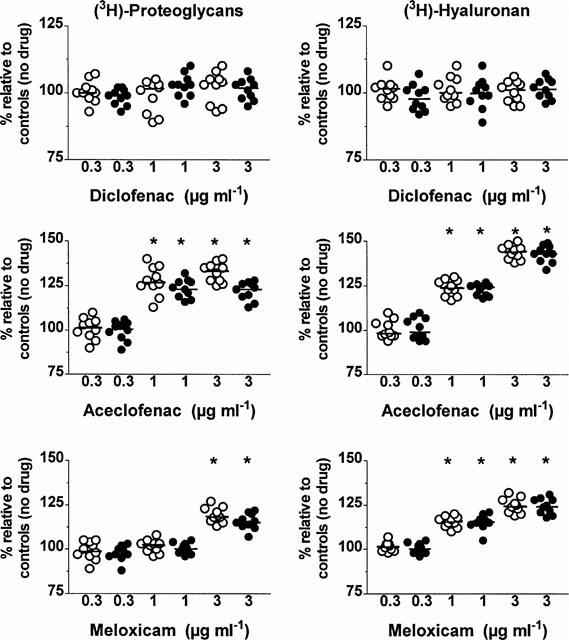
Ảnh hưởng của nồng độ khác nhau (μg ml−1 diclofenac, aceclofenac và meloxicam trên tổng số lượng (mô + môi trường) của các phân tử proteoglycan và hyaluronan mới được tổng hợp trong các tế bào sụn được nuôi cấy của thoái hóa khớp trung bình (vòng tròn trắng) và tế bào sụn được nuôi cấy của thoái hóa khớp nặng (vòng tròn đen). Kết quả được biểu thị bằng tỷ lệ phần trăm (%) của các giá trị quan sát được từ các mô cấy tương ứng được nuôi cấy khi không có thuốc. Đường ngang hiện diện trong mỗi phân tán cột tương ứng với giá trị trung bình. * P: so sánh bởi phương pháp kiểm tra xếp hạng Wilcoxon
.
* Hyaluronan (HA)
Trong các mô cấy MOA và SOA, tổng số phân tử HA mới được tổng hợp không bị ảnh hưởng bởi diclofenac ở nồng độ 0,3, 1 và 3 μg ml−1 , cũng như aceclofenac hoặc meloxicam ở nồng độ 0,3 μg ml−1 (Hình 3). Mặt khác, ở nồng độ 1 và 3 μg ml−1 , cả aceclofenac và meloxicam đều tăng cường tổng hợp HA theo cách tương đối phụ thuộc ở hai nhóm (P = 0,002). Tuy nhiên, quan sát thấy sự gia tăng tổng hợp HA ở hai nồng độ này thì aceclofenac mạnh hơn so với meloxicam (P = 0,002). Không có sự khác biệt có ý nghĩa thống kê về sự gia tăng tổng hợp HA có thể được thể hiện giữa hai nhóm ở nồng độ 1 và 3 μg ml−1 của aceclofenac hoặc meloxicam.
Thảo luận
Dữ liệu được trình bày ở đây là dữ liệu đầu tiên mô tả tác dụng của aceclofenac, diclofenac và meloxicam đối với quá trình chuyển hóa HA trong các tế bào sụn được nuôi cấy ở người bị thoái hóa khớp. Thành phần sụn và sự trao đổi chất khác nhau ở các vùng khác nhau của cùng một khớp và giữa các khớp khác nhau của cùng một cá thể (Muir, 1986; Holmes et al., 1988). Do đó, các mô khớp được lấy mẫu từ cùng một vùng của khớp gối để hạn chế sự thay đổi nồng độ và chuyển hóa của cả proteoglycan và HA. Hơn nữa, do thành phần sụn và sự trao đổi chất cũng thay đổi theo tuổi tác, người hiến tặng có sự phân bố tuổi giống nhau ở cả hai nhóm, do đó sự khác biệt quan sát được khi đáp ứng với NSAID có thể liên quan chặt chẽ hơn đến quá trình bệnh thoái hóa khớp thay vì lão hóa. Nồng độ của ba NSAID được sử dụng trong hệ thống nuôi cấy của chúng tôi tương tự như khoảng dao động tổng nồng độ (ràng buộc và tự do) của các loại thuốc này đã được dò thám thấy trong dịch khớp của người (Bort et al., 1996; Turck et al., 1996). Tuy nhiên, rất khó để đánh giá nồng độ hiệu quả thực tế của thuốc tác động lên mô vì điều này phụ thuộc vào các yếu tố khác nhau như pH của dịch khớp, tính toàn vẹn của bề mặt sụn, hệ số phân chia của thuốc trong mô khớp cũng như liên kết với protein. Hầu hết các NSAID liên kết rộng rãi với protein huyết tương và môi trường nuôi cấy của chúng tôi chứa một tỷ lệ tương đối nhỏ (20%) của huyết thanh. Do đó, có khả năng, với tổng nồng độ 3 μg ml − 1, nồng độ của thuốc tự do trong môi trường nuôi cấy của chúng tôi cao hơn so với hiện diện trong sụn ngấm dịch khớp trong ống nghiệm. Diclofenac không ảnh hưởng đến chuyển hóa HA của sụn OA, trong khi đó, theo cách phụ thuộc liều, cả aceclofenac và meloxicam đều có thể đồng thời làm tăng tổng hợp HA và giảm mất các phân tử HA mới được tổng hợp từ mô khớp. Hơn nữa, tác dụng của aceclofenac mạnh hơn meloxicam. Việc hai NSAID này có tác động tích cực đến cân bằng chuyển hóa của HA rất đáng được nhấn mạnh bởi vì việc giảm dần hàm lượng HA của sụn OA (Manicourt et al., 1988; Rizkalla et al., 1992) có khả năng đóng góp, ít nhất là một phần, vào tiến trình không đổi của bệnh OA (Pita et al., 1992) và tương phản với sự gia tăng liên quan đến tuổi của hàm lượng HA trong sụn khớp bình thường (Holmes et al., 1988).
Hiểu biết của chúng tôi về sự tổng hợp và thoái hóa HA trong sụn khớp vẫn còn rời rạc. Các tế bào sụn biểu hiện hai enzyme synthase HA khác nhau (HAS) được định vị trên bề mặt tế bào, nhưng các đặc điểm enzyme của hai đồng phân HAS cũng như các cơ chế điều hòa của chúng, bao gồm các tác dụng có thể có của NSAID, vẫn còn được làm rõ (Hiscock et al ., 2000). Mặt khác,cho đến nay hyaluronidase đã được xác định không có trong hệ đệm của sụn, người ta cho rằng sự thoái hóa và mất các phân tử HA có thể là kết quả của hoạt động của các gốc tự do có nguồn gốc oxy (ODFR) (Ng et al., 1995). Mặc dù NSAID có thể ngăn chặn việc sản xuất ODFR (Minta & Williams, 1985), nhưng có khả năng là không có yếu tố nào cho thấy tác dụng tích cực của aceclofenac và meloxicam đối với sự chuyển hóa tổng thể của HA trong sụn OA. Do đó, các cơ chế hoạt động chính xác của hai loại thuốc nên được làm sáng tỏ trong các nghiên cứu tiếp theo vì chúng có thể có ý nghĩa sinh học và trị liệu rất lớn trong viêm khớp
Aceclofenac và meloxicam cũng làm giảm sự mất các phân tử proteoglycan từ mô khớp và cả hai thuốc đồng thời tăng cường tổng hợp proteoglycan trong khi diclofenac không ảnh hưởng đến quá trình chuyển hóa tổng thể của sulphated glycosaminoglycans. Các nghiên cứu trong ống nghiệm trước đây đã thực sự chỉ ra rằng, ở nồng độ trong phạm vi trị liệu, NSAID có ảnh hưởng đến khả năng tổng hợp proteoglycan của các tế bào sụn, có thể là kích thích, ức chế hoặc trung tính (Brandt, 1987; Dingle, 1999). Do đó, có khả năng là có một cơ chế khác ngoài ức chế COX cho những khác biệt rõ rệt về tác dụng của các thuốc này đối với sự tổng hợp proteoglycan, một cuộc tranh cãi được nhấn mạnh thêm bởi báo cáo về các chất tương tự PGE 1, misoprostol, không chống lại sự ức chế tổng hợp proteoglycan gây ra bởi NSAID (Brandt et al., 1991). Ức chế sản xuất IL ‐ 1 và kết quả hoạt động của yếu tố tăng trưởng gần đây được cho là cơ chế kích thích khả dụng (Dingle, 1999). Mặt khác, một số NSAID có tác dụng độc hại đối với chuyển hóa tế bào sụn như ức chế glucuronyltransferase, một loại enzyme chịu trách nhiệm kéo dài chuỗi chondroitin sulphate trên các phân tử proteoglycan mới sinh (Hugenberg et al., 1993).
Meloxicam đã tăng cường tỷ lệ tổng hợp proteoglycan tương phản với báo cáo của Rainsford et al. (1997) người phát hiện ra rằng loại thuốc này không bị ảnh hưởng đến việc sản xuất proteoglycan sụn. Những lý do cho sự khác biệt rõ ràng này vẫn chưa được biết, nhưng có thể chúng phản ánh, một phần, sự khác biệt về mức độ mô học - mô hóa học của các tế bào sụn được nuôi cấy. Thật vậy, Dingle (1999) đã báo cáo rằng, trái ngược với sụn OA, sụn bình thường cho thấy không có bằng chứng kích thích proteoglycan với aceclofenac. Tính nhạy cảm cao của sụn khớp bệnh lý đã được quan sát thấy trên cơ thể và trong ống nghiệm với một số NSAID (Brandt, 1987). Mặc dù hiện tại chưa rõ cơ chế chính xác của nó, dữ liệu trong tài liệu cho thấy rằng sự hấp thu NSAID bằng sụn có liên quan nghịch với hàm lượng proteoglycan của hệ đệm (Brandt, 1987). Theo đó, bất kỳ sự giảm nồng độ của các proteoglycan tích điện âm, tỷ lệ thuận với sự nghiêm trọng của quá trình OA, sẽ làm tăng tính thấm của hệ đệm đối với NSAID tích điện.
Việc giảm sự mất đi của proteoglycan do aceclofenac và meloxicam tạo ra, ít nhất là một phần, có liên quan đến tác dụng tích cực của các thuốc này đối với sự chuyển hóa tổng thể của HA, do bất kỳ sự giảm hàm lượng HA nào của sụn đều có khả năng hạn chế sự kết tụ của proteoglycan, do đó, ủng hộ việc mất các phân tử proteoglycan mới được tổng hợp bằng cách khuếch tán hoặc bởi sự thoái hóa proeolytic (Heinegard & Hascall, 1974). Mặt khác, các báo cáo đã chỉ ra rằng, ở nồng độ trong phạm vi trị liệu, một số NSAID ức chế các hoạt động proteoglycanase và collagenase có trong sụn OA (Vignon et al., 1992; Barracchini et al., 1998). Vẫn còn phải xác định xem tác dụng ức chế này của NSAID đối với việc mất proteoglycan là do ức chế sản xuất ODFR (Halliwell, 1995) hay do giảm quá trình tổng hợp metallicoproteinase (MMPs) và các enzyme phân giải protein khác và / hoặc kích thích sự tổng hợp và bài tiết các chất ức chế mô của enzyme phân giải protein (Poole et al., 1995). Các nghiên cứu gần đây cũng cho thấy NSAID có thể đóng vai trò là chất ức chế enzyme có thể đảo ngược (Barracchini và cộng sự, 1998) hoặc bằng cách ức chế COX làm trung gian cảm ứng của metallicoproteinase 1 màng (MMP 14), một loại enzyme có thể kích hoạt gelatinase MMP 2) và collagenase 3 (MMP 13) (Takahashi et al., 1999).
Tóm lại, mặc dù vẫn chưa được xác định liệu những thay đổi quan sát được trong chuyển hóa sụn được nuôi cấy ngắn hạn trong ống nghiệm có thể sẽ xảy ra trong nuối cấy trong cơ thể lâu dài hay không, kết quả được trình bày ở đây cho thấy, trái ngược với diclofenac, aceclofenac và meloxicam ở nồng độ thấp đều được tìm thấy trong dịch của bao hoạt dịch và đều có tác dụng tích cực đối với quá trình chuyển hóa tổng thể của proteoglycan và HA trong sụn OA. Theo đó, hai loại thuốc này không cản trở các đặc tính cơ học của mô khớp và có thể giảm hư tổn của khớp trong viêm khớp. Tuy nhiên, Aceclofenac và meloxicam không thể bình thường hóa những thay đổi trong chuyển hóa sụn trong mô thoái hóa khớp.
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1038/sj.bjp.0703710